¿Qué caracteriza a la estructura de Lewis?
- Es una diagrama de puntos.
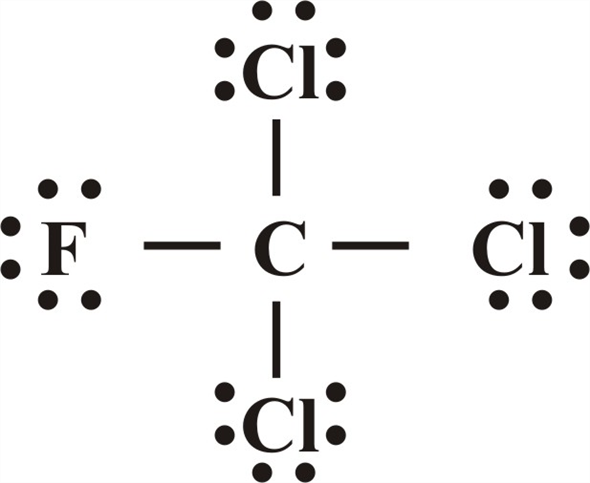
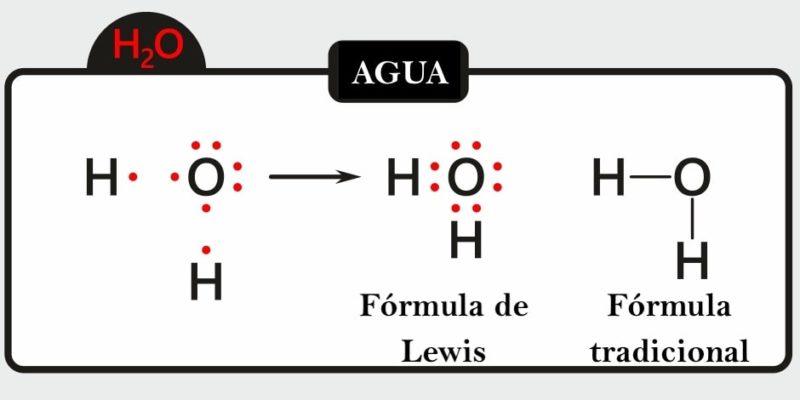
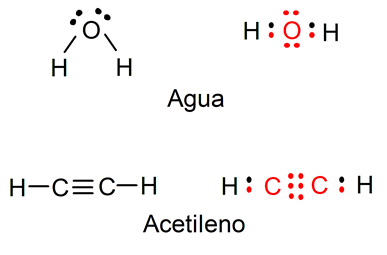
- Es una representación gráfica que indican cuáles son los enlaces que hay en una molécula entre sus átomos y los pares de electrones solitarios que la componen también.
- Son representaciones adecuadas y sencillas de iones y compuestos.
- Se muestran enlaces químicos dentro de la molécula, ya sea explícitamente o implícitamente indicando la ordenación de los átomos en el espacio.
- Muestran los diferentes átomos de una determinada causa usando su símbolo químico y líneas que se trazan entre los átomos que se unen entre sí.
- Representan también si entre los átomos existen enlaces simples, dobles o triples.
- En ocasiones, para representar cada enlace, se usan pares de puntos en vez de líneas.
ESTRUCTURA DE LEWIS⚡ paso a paso con ejercicios. GUÍA UNAM-IPN-COMIPEMS
Fuentes: